µ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤Õōü
µ®¤ĶāĮµĆ¦ŃéÆĶĪ©ńż║ŃüÖŃéŗŃüōŃü©ŃüīŃü¦ŃüŹŃéŗķŻ¤ÕōüŃü»ŃĆüŃüōŃéīŃüŠŃü¦ŃāłŃé»ŃāøŃü©µĀäķżŖµ®¤ĶāĮķŻ¤ÕōüŃü½ķÖÉŃéēŃéīŃü”ŃüäŃüŠŃüŚŃü¤ŃüīŃĆü2015Õ╣┤4µ£łŃü½µ¢░ŃüŚŃüÅŃĆīµ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃĆŹÕłČÕ║”ŃüīŃé╣Ńé┐Ńā╝ŃāłŃüŚŃüŠŃüŚŃü¤ŃĆé
µØ▒µ┤ŗµ¢░Ķ¢¼Ńü»ķŻ¤ŃéÆķĆÜŃüśŃü”ÕüźÕ║ĘŃü½Õ»äõĖÄŃüÖŃéŗõ║ŗµźŁŃü«õĖĆńÆ░Ńü©ŃüŚŃü”ŃĆüŃāłŃé»Ńāøõ║ŗµźŁŃüĀŃüæŃü¦Ńü¬ŃüÅŃĆüŃüØŃü«ŃāÄŃé”ŃāÅŃé”ŃéÆńö¤ŃüŗŃüŚŃĆüµ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü«ķ¢ŗńÖ║Ńü½Ńééµ│©ÕŖøŃüŚŃü”ŃüäŃüŠŃüÖŃĆé
ÕżÜµĢ░Ńü«Õ▒ŖÕć║Õ«¤ńĖŠŃéäÕÅŚĶ©ŚĶŻĮķĆĀÕ«¤ńĖŠŃü½Õ¤║ŃüźŃüŹŃĆüĶ▒ŖÕ»īŃü¬Ńā®ŃéżŃā│ŃāŖŃāāŃāŚŃü«ŃüöµÅɵĪłŃüīÕÅ»ĶāĮŃü¦ŃüÖŃĆé
’╝æ’╝ĵ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüńĘÅÕÉłÕŖøŃā®Ńā│ŃéŁŃā│Ńé░
µ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤Õōü ńĘÅÕÉłÕŖøNo.’╝æŌĆ╗
Õ▒ŖÕć║õ╗ȵĢ░No.’╝æŌĆ╗
Õ▒ŖÕć║Ńü½ķ¢óŃüÖŃéŗĶ▒ŖÕ»īŃü¬ńĄīķ©ōŃéäŃāÄŃé”ŃāÅŃé”ŃéƵ┤╗ńö©ŃüŚŃĆüŃüŖÕ«óµ¦śŃéÆŃéĄŃāØŃā╝ŃāłŃüŚŃüŠŃüÖŃĆé
ńŗ¼Ķć¬Ńé©ŃāōŃāćŃā│Ńé╣µĢ░No.’╝æŌĆ╗
ńĀöń®Čķ¢ŗńÖ║ÕŖøŃü«ķ½śŃüĢŃü¦Ńé©ŃāōŃāćŃā│Ńé╣Ńü«ÕÅ¢ÕŠŚŃüŗŃéēŃéĄŃāØŃā╝ŃāłŃüŚŃüŠŃüÖŃĆé
’╝ł2023Õ╣┤11µ£ł30µŚźµÖéńé╣ŃĆüĶć¬ńżŠĶ¬┐Ńü╣’╝ē
’╝Æ’╝ĵØ▒µ┤ŗµ¢░Ķ¢¼Ńü«Ķ▒ŖÕ»īŃü¬Ńā®ŃéżŃā│ŃāŖŃāāŃāŚ
µ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü«µ®¤ĶāĮµĆ¦Ńā╗Õ«ēÕģ©µĆ¦Ńü«µĀ╣µŗĀŃü»ŃĆüŃüéŃüÅŃüŠŃü¦Ńééõ╝üµźŁĶ▓¼õ╗╗Ńü¦ŃüÖŃĆéŃĆīŃü®ŃéōŃü¬ÕŖ╣µ×£Ńüīµ£¤ÕŠģŃü¦ŃüŹŃéŗŃü«ŃüŗŃĆŹŃüīµśÄńó║Ńü½ŃéóŃāöŃā╝Ńā½Ńü¦ŃüŹŃéŗõĖƵ¢╣ŃĆüÕĢåÕōüńÖ║ÕŻ▓ÕŠīŃééŃüØŃü«µĀ╣µŗĀŃü½Õ»ŠŃüŚŃü”ŃĆüĶĪīµö┐Ńü«ńøŻĶ”¢ŃüīĶĪīŃéÅŃéīŃüŠŃüÖŃĆé
µØ▒µ┤ŗµ¢░Ķ¢¼Ńü¦Ńü»ŃĆüŃāłŃé»ŃāøĶ©▒ÕŻի¤ńĖŠNo.1Ńü«ńĀöń®Čķ¢ŗńÖ║ÕŖøŃéÆńö¤ŃüŗŃüŚŃĆüŃé│Ńā│ŃāŚŃā®ŃéżŃéóŃā│Ńé╣ŃéÆķćŹĶ”¢ŃüŚŃü¤µ£ēÕŖ╣µĆ¦Ńā╗Õ«ēÕģ©µĆ¦Ķ®ĢõŠĪŃéÆĶĪīŃüäŃĆüõĖĆիܵ░┤µ║¢õ╗źõĖŖŃü«ÕĢåÕōüŃéÆÕżÜµĢ░ÕÅ¢ŃéŖµÅāŃüłŃü”ŃüŖŃéŖŃĆüŃüŖÕ«óµ¦śŃü«ŃüöĶ”üµ£øŃü½Õ┐£ŃüśŃü¤µ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃéÆŃüöµÅɵĪłŃüÖŃéŗŃüōŃü©ŃüīŃü¦ŃüŹŃüŠŃüÖŃĆé
ŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀŃā®ŃéżŃā│ŃāŖŃāāŃāŚõŠŗ
- õĮōĶäéĶé¬
- Ńé©ŃāŹŃā½Ńé«Ńā╝µČłĶ▓╗
- Ķé®ŃéäĶģ░ŃüĖŃü«Ķ▓Āµŗģ
- ĶĪĆń│¢ÕĆż
- ĶģĖÕåģńÆ░Õóā
- ŃéóŃéżŃé▒Ńéó(Ńā¢Ńā½Ńā╝Ńā®ŃéżŃāł)
- õĖŁµĆ¦ĶäéĶé¬
- õŠ┐ķĆÜ
- ŃéóŃéżŃé▒Ńéó(ŃāöŃā│ŃāłĶ¬┐ń»Ć)
- Ńé│Ńā¼Ńé╣ŃāåŃāŁŃā╝Ńā½
- ńØĪń£ĀŃü«Ķ│¬
- ńŁŗĶéē
- ķŻ¤ÕŠīÕ░┐ķģĖÕĆż
- µŚźõĖŁń£Āµ░Ś
- ń▓Šńź×ńÜäŃé╣ŃāłŃā¼Ńé╣
- ĶĪĆÕ£¦
- ń¢▓ÕŖ┤µä¤(õĮ£µźŁÕŠī)
- µŁ®ĶĪī
- ĶéīŃü«õ┐ص╣┐
- ń¢▓ÕŖ┤µä¤(ķüŗÕŗĢÕŠī)
- ĶéīŃü«Õ╝ŠÕŖø
- Ķ¬Źń¤ź(Ķ©śµåČ)
- ķ¢óń»Ć
- ķ¬©Ńü«ÕüźÕ║Ę
- ĶĪĆń«ĪŃü«ŃüŚŃü¬ŃéäŃüŗŃüĢ
µØ▒µ┤ŗµ¢░Ķ¢¼Õ▒ŖÕć║µĖłŃü┐ÕĢåÕōüõŠŗ

’╝ō’╝ĵØ▒µ┤ŗµ¢░Ķ¢¼Ńü«ŃāłŃā╝Ńé┐Ńā½ŃéĄŃāØŃā╝ŃāłõĮōÕłČ
ŃĆīµ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃĆŹÕłČÕ║”Ńü»ŃĆüŃāłŃé»ŃāøŃü©Ńü»ńĢ░Ńü¬ŃéŖŃĆüÕ»®µ¤╗Ńü»Ńü¬ŃüäŃééŃü«Ńü«ŃĆüµČłĶ▓╗ĶĆģÕ║üŃü½ŃéłŃéŗÕĮóÕ╝ÅÕ»®µ¤╗Ńü«ŃāÅŃā╝ŃāēŃā½Ńü»Õ┐ģŃüÜŃüŚŃééõĮÄŃüÅŃüéŃéŖŃüŠŃüøŃéōŃĆéõ║ŗÕ«¤ŃĆüķ¢ŗńÖ║ńØƵēŗ’Į×ÕÅŚńÉåŃüŠŃü¦Ńü½ÕżÜŃüÅŃü«Ķ¬▓ķĪīŃüīŃüéŃéŖŃĆüŃü¬ŃüŗŃü¬ŃüŗÕÅŚńÉåŃüĢŃéīŃü¬ŃüäŃü©ŃüäŃüåµé®Ńü┐ŃéÆĶĆ│Ńü½ŃüÖŃéŗŃüōŃü©ŃüīµäÅÕż¢Ńü©ÕżÜŃüäŃééŃü«Ńü¦ŃüÖŃĆé
ŃüōŃüåŃüäŃüŻŃü¤µé®Ńü┐Ńü½Õ»ŠŃüŚŃü”µØ▒µ┤ŗµ¢░Ķ¢¼Ńü»ŃüōŃéīŃüŠŃü¦Ńü«ŃāłŃé»Ńāøõ║ŗµźŁŃü¦Õ¤╣ŃüŻŃü”ŃüŹŃü¤ŃāÄŃé”ŃāÅŃé”ŃéÆŃāĢŃā½µ┤╗ńö©ŃüŚŃĆüµ¦śŃĆģŃü¬ŃāŗŃā╝Ńé║Ńü½Õ»ŠÕ┐£Ńü¦ŃüŹŃéŗŃāłŃā╝Ńé┐Ńā½ŃéĄŃāØŃā╝ŃāłõĮōÕłČŃéƵ¦ŗń»ēŃüŚŃü”ŃüäŃüŠŃüÖŃĆé
| ’╝æ’╝ÄŃé©ŃāōŃāćŃā│Ńé╣ÕÅ¢ÕŠŚ |
|
ŃāłŃé»ŃāøŃü¦Õ¤╣ŃüŻŃü¤ķ½śŃüäķ¢ŗńÖ║ÕŖøŃü¦ŃĆüŃé©ŃāōŃāćŃā│Ńé╣ÕÅ¢ÕŠŚŃéÆŃéĄŃāØŃā╝ŃāłŃüŚŃüŠŃüÖŃĆé Ķ▓┤ńżŠń┤ĀµØÉŃü«µ£ēÕŖ╣µĆ¦Ńā╗Õ«ēÕģ©µĆ¦ŃééĶ®ĢõŠĪŃüŚŃüŠŃüÖŃĆé |
|---|---|---|
| ’╝Æ’╝ÄÕĢåÕōüŃü«Õ▒ŖÕć║ĶĪ©ńż║ĶĆāµĪł |
|
ķŁģÕŖøńÜäŃü¬ÕĢåÕōüŃü«Õ▒ŖÕć║ĶĪ©ńż║’╝łŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀ’╝ēŃéÆŃüöµÅɵĪłŃüŚŃüŠŃüÖŃĆé |
| ’╝ō’╝ÄÕĢåÕōüĶ©ŁĶ©ł |
|
ÕĢåÕōüõĖŁŃü«µ®¤ĶāĮµĆ¦ķ¢óõĖĵłÉÕłåŃü«Õ«Üķćŵ¢╣µ│ĢŃéÆńó║ń½ŗŃüŚŃĆüÕĢåÕōüŃü«Õ«ēÕ«ÜµĆ¦Ķ®”ķ©ōŃéÆĶĪīŃüäŃüŠŃüÖŃĆé Õē»ń┤ĀµØÉŃü«Õ«ēÕģ©µĆ¦ŃééĶ®ĢõŠĪŃüŚŃüŠŃüÖŃĆé |
| ’╝ö’╝ĵȳĶ▓╗ĶĆģÕ║üŃüĖŃü«Õ▒ŖÕć║ |
|
µČłĶ▓╗ĶĆģÕ║üŃüĖŃü«Õ▒ŖÕć║µøĖķĪ×õĮ£µłÉŃéäÕ▒ŖÕć║ŃéÆŃéĄŃāØŃā╝ŃāłŃüŚŃüŠŃüÖŃĆé |
| ’╝Ģ’╝ÄĶŻĮķĆĀŃā╗µż£µ¤╗ |
|
GMPŃü½µ║¢µŗĀŃüŚŃü¤ŃĆüÕ╝ĘÕø║Ńü¬ÕōüĶ│¬ń«ĪńÉåõĮōÕłČŃü«ŃééŃü©Ńü¦ĶŻĮķĆĀŃüŚŃüŠŃüÖŃĆé
|
ŃüŠŃü¤ŃĆüõ╗źõĖŗŃü«ŃéłŃüåŃü¬ŃāŚŃā®Ńā│ŃééŃüöńö©µäÅŃüŚŃĆüŃüŖÕ«óµ¦śŃü«µ¦śŃĆģŃü¬ŃüöĶ”üµ£øŃü½Ķ┐ģķƤŃü½ŃüŖÕ┐£ŃüłŃüŚŃüŠŃüÖŃĆé
µŚ®ŃüĢķćŹĶ”¢Ńü¦Ńü«ÕĢåÕōüÕī¢
Ķ▒ŖÕ»īŃü¬ŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀŃüŗŃéēµ£Ćķü®Ńü¬ŃééŃü«ŃéÆŃüöµÅɵĪłŃüŚŃüŠŃüÖŃĆéÕ▒ŖÕć║µøĖķĪ×Ńü«õĮ£µłÉŃü»ŃééŃüĪŃéŹŃéōŃĆüĶ▓®ÕŻ▓õ┐āķĆ▓Ńü«Ńü¤ŃéüŃü«ŃāäŃā╝Ńā½õĮ£µłÉµö»µÅ┤ŃééÕÅ»ĶāĮŃü¦ŃüÖŃĆé
Ńé¬Ńā¬ŃéĖŃāŖŃā½ÕĢåÕōüķ¢ŗńÖ║
ŃüōŃüĀŃéÅŃéŖń┤ĀµØÉŃéÆŃāŚŃā®Ńé╣ŃüŚŃü¤ŃĆüńŗ¼Ķ欵ƦŃü«ķ½śŃüäµ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü«ķ¢ŗńÖ║ŃüīÕÅ»ĶāĮŃü¦ŃüÖŃĆéµ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤Õōüķ¢ŗńÖ║Ńü¦ķćŹĶ”üŃü¬ŃĆüÕ«ēÕģ©µĆ¦ŃĆüńøĖõ║ÆõĮ£ńö©ńŁēŃü«µāģÕĀ▒ÕÅÄķøåŃā╗µż£Ķ©ÄŃü½ŃééÕ»ŠÕ┐£ŃüŚŃüŠŃüÖŃĆé
µ¢░Ķ”ÅŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀķ¢ŗńÖ║
õ╗ŖŃüŠŃü¦Ńü½Ńü¬ŃüäŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀŃééŃüöńøĖĶ½ćŃüÅŃüĀŃüĢŃüäŃĆéµ®¤ĶāĮµĆ¦ķ¢óõĖĵłÉÕłåŃü«µÄóń┤óŃüŗŃéēŃé©ŃāōŃāćŃā│Ńé╣ÕÅ¢ÕŠŚ(ńĀöń®ČŃā¼ŃāōŃāźŃā╝ńŁē)ŃĆüÕĢåÕōüĶ©ŁĶ©łŃĆüĶŻĮķĆĀŃā╗µż£µ¤╗Ńü½Ķć│ŃéŗŃüŠŃü¦ŃĆüµ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü½Õ┐ģĶ”üŃü¬Õģ©Ńü”ŃéÆŃĆüŃāłŃā╝Ńé┐Ńā½Ńü½ŃéĄŃāØŃā╝ŃāłŃüŚŃüŠŃüÖŃĆé
’╝ö’╝ĵ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü©Ńü»’╝¤
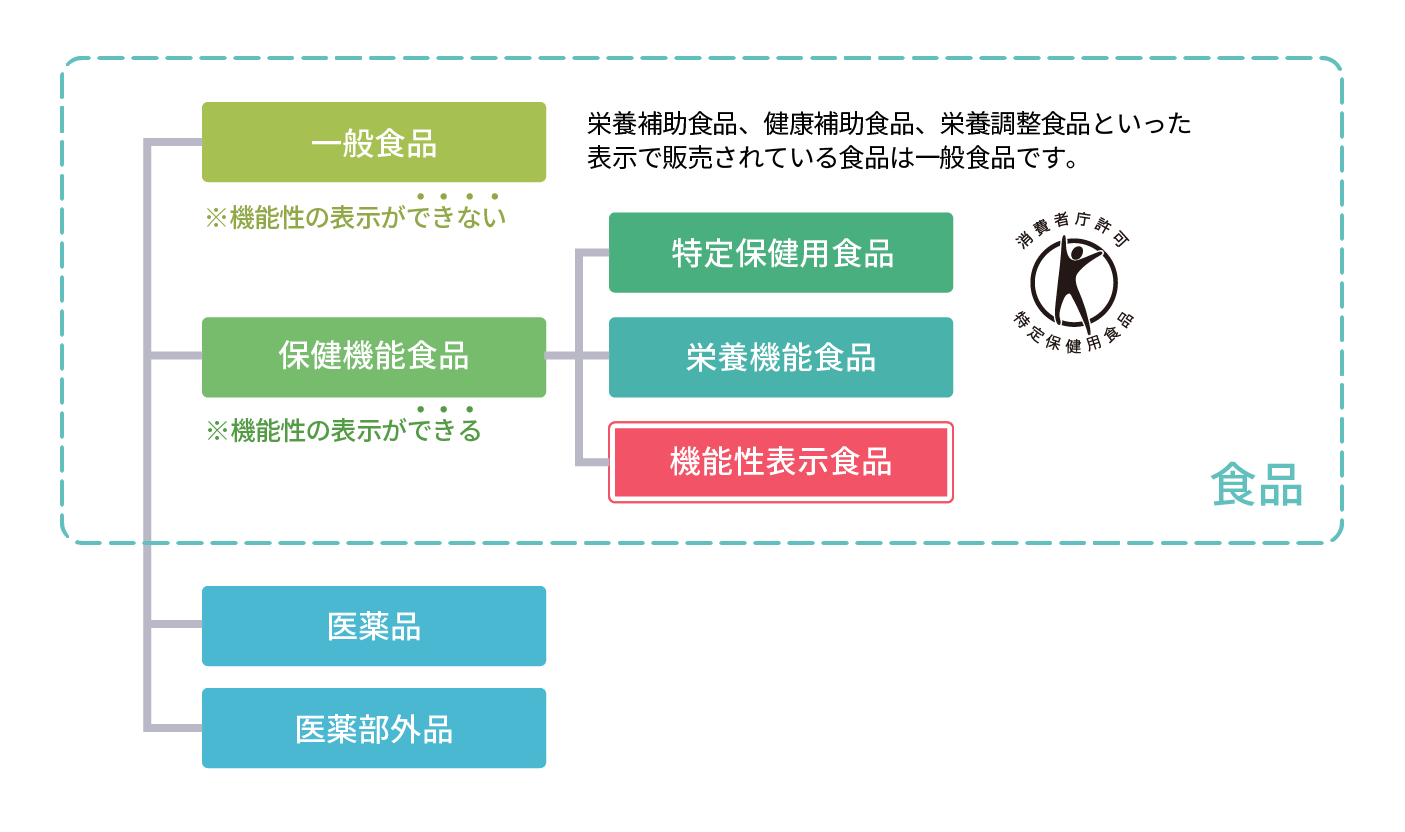
õ║ŗµźŁĶĆģŃü«Ķ▓¼õ╗╗Ńü½ŃüŖŃüäŃü”ŃĆüń¦æÕŁ”ńÜäµĀ╣µŗĀŃü½Õ¤║ŃüźŃüäŃü¤µ®¤ĶāĮµĆ¦ŃéÆĶĪ©ńż║ŃüŚŃü¤ķŻ¤ÕōüŃü¦ŃüÖŃĆé
Ķ▓®ÕŻ▓ÕēŹŃü½Õ«ēÕģ©µĆ¦ÕÅŖŃü│µ®¤ĶāĮµĆ¦Ńü«µĀ╣µŗĀŃü½ķ¢óŃüÖŃéŗµāģÕĀ▒Ńü¬Ńü®ŃüīµČłĶ▓╗ĶĆģÕ║üķĢĘÕ«śŃüĖÕ▒ŖŃüæÕć║ŃéēŃéīŃü¤ŃééŃü«Ńü¦ŃüéŃéŖŃĆüµČłĶ▓╗ĶĆģÕ║üķĢĘÕ«śŃü«ÕĆŗÕłźŃü«Ķ©▒ÕÅ»ŃéÆÕÅŚŃüæŃü¤ŃééŃü«Ńü¦Ńü»Ńü¬Ńüäńé╣ŃüīŃĆüŃāłŃé»ŃāøŃü©Ńü»ńĢ░Ńü¬ŃéŖŃüŠŃüÖŃĆé
’╝Ģ’╝ĵ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü«Ķ▓®ÕŻ▓ŃüŠŃü¦Ńü«ŃāŚŃāŁŃé╗Ńé╣
µ®¤ĶāĮµĆ¦ĶĪ©ńż║ķŻ¤ÕōüŃü«Õ»ŠĶ▒ĪµłÉÕłåŃü©Ńü¬ŃéŗŃüŗŃéÆÕłżµ¢ŁŃüÖŃéŗ
ŌŚÅµłÉÕłåŃü½ŃüżŃüäŃü”ń░ĪµśōĶ¬┐µ¤╗’╝łµ£ēÕŖ╣µĆ¦ŃĆüÕ«ēÕģ©µĆ¦’╝ēŃéÆĶĪīŃüäŃĆüÕÅ»ĶāĮµĆ¦Ńü«ŃüéŃéŗŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀŃéÆŃāöŃāāŃé»ŃéóŃāāŃāŚŃĆé
ŌŚÅńŗÖŃüåŃāśŃā½Ńé╣Ńé»Ńā¼Ńā╝ŃāĀŃüīŃĆüÕüźÕ║ĘŃü«ńČŁµīüŃā╗ÕóŚķĆ▓Ńü«ń»äÕø▓ÕåģŃü©ŃüäŃüłŃéŗŃüŗµż£Ķ©ÄŃüÖŃéŗŃĆé

Õ«ēÕģ©µĆ¦Ńü«µĀ╣µŗĀŃéƵśÄńó║Ńü½ŃüÖŃéŗ
ŌŚÅķŻ¤ńĄīķ©ōŃé䵌óÕŁśµāģÕĀ▒Ńü«ÕÅÄķøåŃĆüÕ«ēÕģ©µĆ¦Ķ®”ķ©ōŃü«Õ«¤µ¢ĮŃü½ŃéłŃéŖÕ«ēÕģ©µĆ¦ŃéÆĶ®ĢõŠĪŃĆé
ŌŚÅÕī╗Ķ¢¼ÕōüŃü©Ńü«ńøĖõ║ÆõĮ£ńö©Ńü¬Ńü®Ńü½ŃüżŃüäŃü”Ķ®ĢõŠĪŃĆé

ńö¤ńöŻŃā╗ĶŻĮķĆĀÕÅŖŃü│ÕōüĶ│¬Ńü«ń«ĪńÉåõĮōÕłČŃéƵĢ┤ŃüłŃéŗ
ŌŚÅńö¤ńöŻŃā╗ĶŻĮķĆĀŃü½ŃüŖŃüæŃéŗĶĪøńö¤ń«ĪńÉåŃā╗ÕōüĶ│¬ń«ĪńÉåŃü«Ķ”│ńé╣ŃüŗŃéēŃĆüÕ«ēÕģ©µĆ¦Ńüīńó║õ┐ØŃü¦ŃüŹŃéŗõĮōÕłČŃéƵĢ┤ŃüłŃéŗŃĆé

ÕüźÕ║ĘĶó½Õ«│Ńü«µāģÕĀ▒ÕÅÄķøåõĮōÕłČŃéƵĢ┤ŃüłŃéŗ
ŌŚÅÕüźÕ║ĘĶó½Õ«│Ńü«ńÖ║ńö¤Ńü«µ£¬ńäČķś▓µŁóÕÅŖŃü│µŗĪÕż¦ķś▓µŁóŃü«Ńü¤ŃéüŃĆüµāģÕĀ▒ÕÅÄķøåŃüŚŃĆüÕĀ▒ÕæŖŃéÆĶĪīŃüåõĮōÕłČŃéƵĢ┤ŃüłŃéŗŃĆé

µ®¤ĶāĮµĆ¦Ńü«µĀ╣µŗĀŃéƵśÄńó║Ńü½ŃüÖŃéŗ
ŌŚÅõ╗źõĖŗŃü«ŃüäŃüÜŃéīŃüŗŃü½ŃéłŃüŻŃü”ŃĆüĶ®ĢõŠĪŃĆé
Ńā╗µ£ĆńĄéĶŻĮÕōüŃéÆńö©ŃüäŃü¤Ķć©Õ║ŖĶ®”ķ©ō
Ńā╗µ£ĆńĄéĶŻĮÕōüŃüŠŃü¤Ńü»µ®¤ĶāĮµĆ¦ķ¢óõĖĵłÉÕłåŃü½ķ¢óŃüÖŃéŗńĀöń®ČŃā¼ŃāōŃāźŃā╝

ķü®µŁŻŃü¬ĶĪ©ńż║ŃéÆĶĪīŃüå
ŌŚÅķŻ¤ÕōüĶĪ©ńż║Õ¤║µ║¢ńŁēŃü½Õ¤║ŃüźŃüŹķü®µŁŻŃü¬ĶĪ©ńż║ŃéÆĶĪīŃüåŃĆé
ŌŚÅÕŠŚŃéēŃéīŃü¤Ńé©ŃāōŃāćŃā│Ńé╣ŃüŗŃéēŃĆüń¦æÕŁ”ńÜäµĀ╣µŗĀŃü½ÕŹ│ŃüŚŃĆüŃüŗŃüżõĖĆĶł¼µČłĶ▓╗ĶĆģŃü½õ╝ØŃéÅŃéŗÕ▒ŖÕć║ĶĪ©ńż║ŃéÆĶĆāµĪłŃüÖŃéŗŃĆé

Õ▒ŖÕć║
ŌŚÅµČłĶ▓╗ĶĆģÕ║üŃü½ŃéłŃéŗÕ▒ŖÕć║µāģÕĀ▒Ńü«ńó║Ķ¬ŹŃĆé
Ńā╗Ķ▓®ÕŻ▓ŃéÆõ║łÕ«ÜŃüÖŃéŗµŚźŃü«60µŚźÕēŹŃüŠŃü¦Ńü½ŃĆüÕ▒ŖÕć║µāģÕĀ▒ŃéÆõĖŹÕéÖŃü¬ŃüŵĢ┤ŃüłµČłĶ▓╗ĶĆģÕ║üķĢĘÕ«śŃü½Õ▒ŖŃüæÕć║ŃéŗŃĆé
Ńā╗Ķ©śĶ╝ēµ╝ÅŃéīŃü¬Ńü®ŃĆüÕĮóÕ╝ÅõĖŖŃü«õĖŹÕéÖŃüīŃüéŃüŻŃü¤ÕĀ┤ÕÉłŃü»ŃĆüÕ▒ŖÕć║µāģÕĀ▒ŃüīÕĘ«µł╗ŃüŚŃüĢŃéīŃéŗŃĆé

Õ▒ŖÕć║ńĢ¬ÕÅĘŃü«ÕÅŚķĀś
ŌŚÅµČłĶ▓╗ĶĆģÕ║üŃü«Ńé”Ńé¦Ńā¢ŃéĄŃéżŃāłŃü¬Ńü®Ńü¦µāģÕĀ▒Ńüīķ¢ŗńż║ŃüĢŃéīŃéŗŃĆé










